
氪
氪是一种化学元素,是一种无色、无臭、无味的惰性气体,把它放电时呈橙红色,在大气中含有痕量,可通过分馏从液态空气中分离,氪的多条谱线使离子化的氪气放电管呈白色,注入氪气的电灯泡是很光亮的白色光源,常用于製作萤光灯。氪正如其他惰性气体一样,化学性质极不活泼,不易与其他物质产生化学作用,已知的化合物有二氟化氪。
基本介绍
- 中文名:氪
- 英文名:krypton
- 分子量:83.8
- 元素类型:非金属单质
- 原子序数:36
- 发现人:拉姆赛
- 元素符号:Kr
研究历史
1898年,英国的拉姆赛和特拉威斯用光谱分析液态空气蒸发氧气、氮气、氩后所剩下的残余气体时,发现了氪。 氪
氪
 氪
氪1898年5月24日拉姆赛获得汉普逊送来的少量液态空气。拉姆赛和特拉弗斯让液态空气蒸发,易挥发的也就是沸点较低的组分从液态中先走出来,留下不易挥发的,也就是沸点较高的组分。他们又用赤热的铜和镁将沸点较高的组分中残留的氧和氮除去,研究了这个剩余部分蒸气的光谱,发现除氩线外,还有两条明亮的谱线,一条黄的,一条绿的。黄色的线比氦线略带绿色。这是以前从来没有见到过的。这表明,在这个残留的气体中,除氩外,还有另一种新的气体。拉姆赛决定把它叫做氪krypton(Kr),来自希腊文krptos。根据实验记录,这个时间是1898年5月30日。他们测定了氪的密度约等于41,原子量约等于82,应当把它放置在元素周期表金属铷的前面。
氪正如其他惰性气体一样,不易与其他物质产生化学作用。但1962年首次合成出氙的化合物后,二氟化氪(KrF2)也在1963年成功合成。同年,格罗泽等人宣布合成出四氟化氪(KrF4),但后来证实为鉴定错误。另外有未经证实的报告指出发现氪含氧酸的钡盐。已有研究发现多原子离子ArKr和KrH,也有KrXe或KrXe存在的证据。
从氪的沸点看,它比氦、氖、氮、氩和氧的沸点都高,只是低于氙,因而被留在沸点较高的组分中被发现。
元素分布
氪的唯一工业来源是空气,在矿石和陨石中只发现了痕量的氪。氪在地球大气中的含量为0.000.114 %(体积),天然氪是6种稳定同位素的混合物,由铀裂变和其他核反应产生的氪的放射性同位素约有20种。 氪原子光谱
氪原子光谱
 氪原子光谱
氪原子光谱物理性质
氪在通常条件下为无色、无臭、无味的气体,比空气约重2倍。
CAS号 | 7439-90-9 |
原子体积(立方厘米/摩尔) | 38.9 |
元素在海水中的含量:(ppm) | 0.00008 |
地壳中含量(ppm) | 0.00001 |
熔点 | -156.6℃ |
沸点 | -152.3℃ |
气体密度 | 3.736克/升(0℃,100千帕) |
100升空气中约含氪 | 0.114毫升 |
临界温度 | -62.35℃ |
临界压力 | 临界压力5.500千帕 |
声音在其中的传播速率(m/s) | 220 |
晶体结构 | 晶胞为面心立方晶胞 |
原子层排布 | 3d104s24p6 |
晶胞参数:
a = 570.6 pm |
b = 570.6 pm |
c = 570.6 pm |
α = 90° |
β = 90° |
γ = 90° |
化学性质
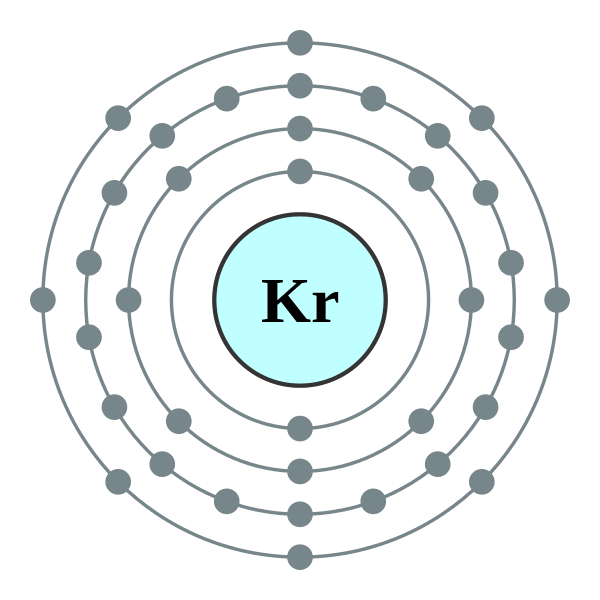 氪的电子分布
氪的电子分布原子序数 | 36 |
质子数 | 36 |
摩尔质量 | 84 |
氧化态 | Main Kr0, Kr+2 |
电子层排布 | 2-8-18-8 |
电离能 (kJ/ mol):
M - M+ 1350.7 |
M+ - M2+ 2350 |
M2+ - M3+ 3565 |
M3+ - M4+ 5070 |
M4+ - M5+ 6240 |
M5+ - M6+ 7570 |
M6+ - M7+ 10710 |
M7+ - M8+ 12200 |
M8+ - M9+ 22229 |
M9+ - M10+ 28900 |
由于氪处于全充满结构,拥有稳定的电子构型,曾被认为没有反应活性。直到20世纪60年代初才发现,氪与氟气同置于一放电管中时可以化合,生成二氟化氪: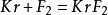 ,KrF2的稳定性相对XeF2较差,在-80℃是较为稳定。
,KrF2的稳定性相对XeF2较差,在-80℃是较为稳定。
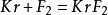
氪还能形成笼形包合物,氪被包在冰、有机化合物(对苯二酚、苯酚、氢醌晶体)或小分子(O2、SO2、H2S、CH3CN、CH3OH)中。在这些包合物中,氪以分子间力结合,如Kr·6H2O,但并没有成键,当这种包合物溶解时,氪就逃逸出来。
铀经过核裂变后会释出氪。与氟以外原子成链的氪化合物已有发现,KrF2和B(OTeF5)3反应会得出不稳定的Kr(OTeF5)2,该化合物中氪与氧成链;KrF2和[HC≡NH]+[AsF−6]在−50℃反应则会得出存在氪氮链的正离子[HC≡N–Kr–F]+。根据报告,HKrCN和HKrC≡CH在40K以下是稳定的。
天然氪是6种稳定同位素的混合物,它们的体积比为氪-84(57%)、氪-86(17.3%)氪-82(11.6%)、氪-83(11.5%)、氪-80(2.25%)和氪-78(0.35%)。由铀裂变和其他核反应产生的氪的放射性同位素约有20种,氪–85的半衰期为10.73年。
氪有约30个已知的不稳定同位素和同质异能素。氪81半衰期为230.000年,是大气反应的产物,可以与其他天然氪同位素一同製备。氪在接近地表水时极易挥发,但氪81可用于鉴定地下水的年代(可推算5万至80万年前)。
氪85是非活性的、放射性的惰性气体,半衰期为10.76年,会由铀和钸的裂变释出,例如核武器爆炸和核反应堆都会释出氪85,在回收核反应堆的燃料棒时都会释出。因为大多核反应堆都位于北半球,北极的氪85浓度比南极的高约30%。
主要用途
有一些使用在填充在白炽灯泡中。机场跑道的照明也是用氪。

广泛用于电子、电光源工业,还用于气体雷射器和等离子流中。
因其透射率特别高,大量用作矿灯、越野车照射灯。
医学上,氪的同位素用作显蹤剂。
液体氪可用作气泡室,探测粒子的轨迹。
放射性氪可用于密闭容器的检漏和材料厚度的连续性测定,还可以製成不需电能的原子灯。
用于材料的“氪化”处理,以作为材料的耐腐蚀、耐磨性能的标记。
氪用于某些萤光灯和高速摄影用闪光灯中,在高效白炽灯、灯泡和闸流管中用作惰性保护气体。放射性氪–85可用于探测密闭容器的裂缝,逸出的氪原子可利用它们的放射性进行检测。稳定的氪–86发射出的光中有一橙红色谱线,由于该谱线极锐,1960~1983年其波长用作长度米的国际标準(1米等于该谱线波长的1.650.763.73倍)。
製取方法
- 从合成氨尾气中提取氪合成氨尾气提氩工艺流程副产氪和氙混合气,再经精馏、洗涤、除氧、吸附、解吸可製得99%氪气。
- 空分法,从空分装置中提取氪、氙混合气。经提取贫氪、清除碳氢化合物和二氧化碳、分离,製得99.99%的纯氪。
- 从核反应堆裂变气中提取氪综合利用核反应堆的裂解废气中放射性的Kr85。
- 工业上实现的有氟里昂溶剂吸收法。
- 工业上用分馏液体空气製得。
- 可从大型的空气液化分离塔内,在制氧或氮的同时从抽出的馏份中分出。
健康危害
氪无毒性,但因其麻醉性比空气高7倍以上,恐有窒息性之可能。
吸入含有50%氪和50%空气的气体所引致的麻醉相当于在4倍大气压力之下吸入空气,也相当于在30米水深潜水。
 读书笔记摘抄新闻资讯
读书笔记摘抄新闻资讯