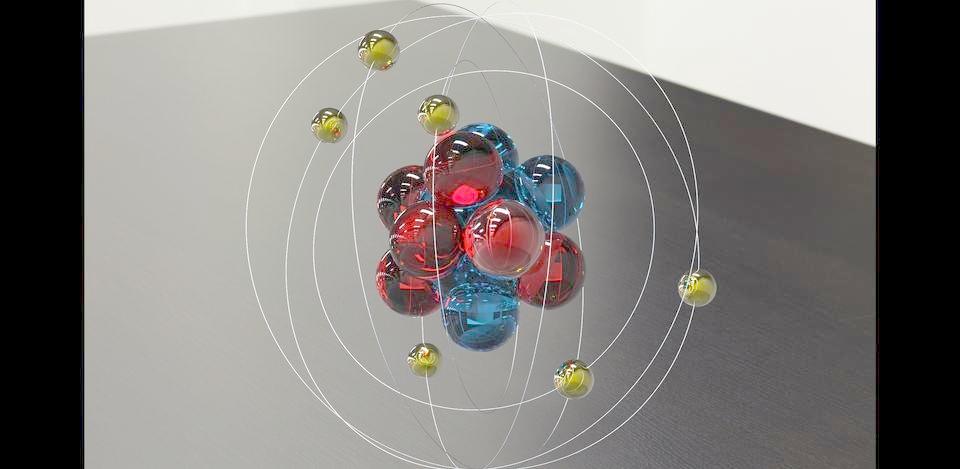
碳原子
碳原子(carbon) 化学符号:C 元素原子量:12.011 质子数:6 原子序数:6 周期:2 族:IVA
自然产生的碳由三种同位素组成:12C和13C为稳定同位素,而14C则具放射性。其半衰期约为5,730年,是少数几个自远古就被发现的元素之一,是构成碳基生物的最基本元素。
基本介绍
- 中文名:碳原子
- 英文名:carbon
- 化学式:C
- 熔点:约为3550 ℃(金刚石)
- 沸点:约为4827 ℃(升华)
- 外观:固态,黑色(石墨), 无色(金刚石)
- 元素原子量:12.011
- 质子数:6
- 周期:2
- 族:IVA
- 电子层分布:2-4
- 原子体积: 4.58 cm3/mol
物理性质
碳原子(carbon)
化学符号:C
元素原子量:12.011
质子数:6
原子序数:6
周期:2
族:IVA
电子层分布:2-4
原子体积: 4.58 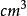 /mol
/mol
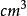
原子半径:91pm
共价半径:77 pm
范德华半径: 170 pm
电子构型:1s22s22p2
电子在每能级的排布: 2,4
氧化价(氧化物): 4,3,2(弱酸性)
颜色和外表:黑色(石墨), 无色(金刚石)
物质状态 :固态
物理属性:反磁性
熔点:约为3550 ℃(金刚石)
沸点:约为4827 ℃(升华)
摩尔体积:5.29×10-6m3/mol
元素在太阳中的含量:(ppm) 3000
元素在海水中的含量:(ppm)太平洋表面 23
元素在地壳中含量:(ppm)4800
莫氏硬度:石墨1-2 ,金刚石 10
氧化态: 主要为-4,,C+2, C+4 (还有其他氧化态)
化学键能: (kJ /mol) C-H 411 C-C 348 C=C 614 C≡C 839 C=N 615 C≡N 891 C=O 745 C≡O 1074
晶胞参数: a = 246.4 pm b = 246.4 pm c = 671.1 pm α = 90° β = 90° γ = 120°
电离能:(kJ/ mol) M - M+ 1086.2 M+ - M2+ 2352 M2+ - M3+ 4620 M3+ - M4+ 6222 M4+ - M5+ 37827 M5+ - M6+ 47270 。
单质密度:3.513 g/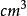 (金刚石)、2.260 g/
(金刚石)、2.260 g/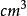 (石墨,20 ℃)
(石墨,20 ℃)
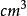
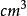
电负性:2.55(鲍林标度)
比热:710 J/(kg·K)
电导率:0.061×10-6/(米欧姆)
热导率:129 W/(m·K)第一电离能1086.5 kJ/mol 第二电离能2352.6 kJ/mol 第三电离能 4620.5 kJ/mol 第四电离能 6222.7 kJ/mol 第五电离能 37831 kJ/mol 第六电离能 47277.0 kJ/mol 。
成键:碳原子一般是四价的,这就需要4个单电子,但是其基态只有2个单电子,所以成键时总是要进行杂化。最常见的杂化方式是sp3杂化,4个价电子被充分利用,平均分布在4个轨道里,属于等性杂化。
这种结构完全对称,成键以后是稳定的σ键,而且没有孤电子对的排斥,非常稳定。金刚石中所有碳原子都是这种以此种杂化方式成键。烷烃的碳原子也属于此类。
同位素:C12\C14(考古测定年代)。
构成结构:直链、支链和环状结构。
同位素
所有碳同位素的原子都有6颗质子,但中子数各异(从2到16颗不等)。碳有两个自然存在的稳定同位素:碳-12(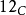 )占地球上碳的98.93%,而碳-13(
)占地球上碳的98.93%,而碳-13(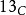 )则占剩余的1.07%。生物体中
)则占剩余的1.07%。生物体中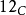 同位素的比率更高,因为生物化学反应会选择性地消除
同位素的比率更高,因为生物化学反应会选择性地消除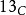 。1961年,国际纯粹与套用化学联合会(IUPAC)决定以碳-12同位素作为原子量单位的定义标準。核磁共振所探测的就是
。1961年,国际纯粹与套用化学联合会(IUPAC)决定以碳-12同位素作为原子量单位的定义标準。核磁共振所探测的就是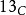 。
。
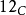
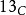
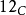
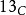
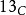
碳-14(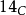 )是自然产生的放射性同位素,在地球上的丰度为一万亿分之一(0.0000000001%),主要存在于大气层和地表矿藏中,如泥炭及其他有机物质等。碳-14以0.158 MeV能量进行β−衰变,由于半衰期只有5730年,所以该同位素在古老岩石中几乎绝迹,但会在大气高层(低平流层及高对流层)中经宇宙射线和氮间的反应而不断产生。
)是自然产生的放射性同位素,在地球上的丰度为一万亿分之一(0.0000000001%),主要存在于大气层和地表矿藏中,如泥炭及其他有机物质等。碳-14以0.158 MeV能量进行β−衰变,由于半衰期只有5730年,所以该同位素在古老岩石中几乎绝迹,但会在大气高层(低平流层及高对流层)中经宇宙射线和氮间的反应而不断产生。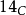 在大气层及生物体中的丰度几乎守恆,但在生物体死亡后有规律地衰减,这就是放射性碳定年法的原理。该定年法可测量年龄在4万年以下的含碳物质。
在大气层及生物体中的丰度几乎守恆,但在生物体死亡后有规律地衰减,这就是放射性碳定年法的原理。该定年法可测量年龄在4万年以下的含碳物质。
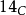
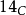
碳有15种已知同位素,其中存活时间最短的是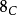 ,它会进行质子发射和α衰变,半衰期为1.98739x10−21秒。
,它会进行质子发射和α衰变,半衰期为1.98739x10−21秒。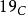 同位素有核晕效应,即其半径比密度均匀的正常球体原子核高得多。
同位素有核晕效应,即其半径比密度均匀的正常球体原子核高得多。
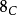
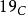
 读书笔记摘抄新闻资讯
读书笔记摘抄新闻资讯