无机化合物
英文:inorganic compound.无机化合物,与机体无关的化合物(少数与机体有关的化合物也是无机化合物,如水),与有机化合物对应,通常指不含碳元素的化合物,但包括碳的氧化物、硫化物、碳酸盐、氰化物、碳硼烷、羰基金属等在无机化学中研究的含碳化合物,简称无机物。
2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,无机铅化合物在2A类致癌物清单中。
基本介绍
- 中文名:无机化合物
- 外文名:inorganic compound.
分类
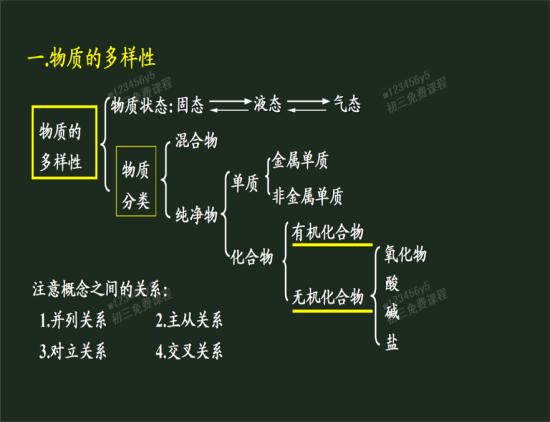
自然界绝大多数的无机物可以归入氧化物、酸、硷和盐4大类。生物体中的无机物主要有水及一些无机离子,如Na+、K+、Ca2+、Mg2+、Cl-、SO42-、等。人体组织中几乎含有自然界存在的各种元素,其中除碳、氢、氧和氮主要以有机化合物形式存在外,其余的统称为无机物(矿物质或灰分).所以,无机物主要是由:水和无机盐组成的,其中水又可以分类为:结合水和自由水,结合水是细胞结构的重要组成成分,自由水是良好的溶剂,运输物质,参与化学反应。无机盐可分为:离子和化合物,离子是维护细胞正常的生命活动,化合物是细胞内化合物的重要组成物分。 氧化铬
氧化铬
 氧化铬
氧化铬氧化物
由两种元素组成,其中一种元素是氧元素的化合物。能和氧气反应产生的物质叫做氧化物。根据化学性质不同,氧化物可分为酸性氧化物和硷性氧化物两大类。酸性氧化物:能与水作用成酸或与硷作用成盐的氧化物。例如三氧化硫、五氧化二磷、二氧化碳等,非金属氧化物大多数是酸性氧化物。
硷性氧化物:能跟酸起反应生成盐和水的氧化物,且生成物只能有盐和水,不可以有任何其它物质生成。硷性氧化物包括活泼金属氧化物和其他金属的低价氧化物,如CaO、BaO和CrO、MnO。
无机酸
一类在水溶液中能电离产生H 的化合物的总称,与硷相对。盐酸、硫酸、硝酸在水溶液中电离时,产生的阴离子(酸根)虽各不相同,但产生的阳离子(H )却是相同的 , 因此它们在性质上有共同的地方,例如具有酸味;能溶解许多金属;能使蓝色石蕊试纸变红等。狭义的定义:在水溶液中电离出的阳离子全部都是氢离子的化合物(比如硫酸)。这类物质大部分易溶于水中,少部分,如:硅酸,难溶于水。酸的水溶液一般可导电,部分酸在水中以分子的形式存在,不导电;部分酸在水中离解为正负离子,可导电。
较广义的定义:反应中能提供质子的是酸,定义酸为电子对的接受者,範围更为广泛。酸可以和硷进行中和作用,生成水和盐。
硷
味苦的、溶液能使特定指示剂变色的物质(如使石蕊变蓝,使酚酞变红等),PH值大于7。在水溶液中电离出的阴离子全部是氢氧根离子,与酸反应形成盐和水。典型的硷如胺类物质(包括氨水),烧硷(氢氧化钠),熟石灰(氢氧化钙)等。硷的更广义的概念是指提供电子的物质,或是接受质子的物质。 氢氧化钙
氢氧化钙
 氢氧化钙
氢氧化钙盐
 氯化钠
氯化钠酸与硷中和的产物,由金属离子(包括铵根离子)与酸根离子构成。化学中盐分为三类,正盐:单由金属离子(包括铵根离子)和非金属离子构成;酸式盐:由金属离子(包括铵根离子)、氢离子和非金属离子构成;硷式盐:由金属离子(包括铵根离子)、氢氧根离子和非金属离子构成。盐是化学工业的重要源料,它可製成氯气、金属钠、纯硷(碳酸钠)、重硷(碳酸氢钠、小苏打)、烧硷(苛性纳、氢氧化钠)和盐酸。
命名规定
无机化合物的命名,应力求简明而确切地表示出被命名物质的组成和结构。这就需要用元素、根或基的名称来表达该物质中的各个组分;用“化学介词”(起着连线名词的作用)来表达该物质中各组分的连线情况。
命名须知
(1)化学介词:化合物的系统名称是由其基本构成部分名称连缀而成的。化学介词在文法上就是连缀基本构成部分名称以形成化合物名称的连缀词。列举如下。
①化 表示简单的化合。如氯原子(Cl)与钾原子(K)化合而成的KCl就叫氯化钾;又如氢氧基(OH-)与钠原子(Na)化合而成的NaOH就叫氢氧化钠。
②合 表示分子与分子或分子与离子相结合。如CaCl2·H2O叫水合氯化钙,H3O叫水合氢离子。
③代 a.表示取代了母体化合物中的氢原子,如NH2Cl叫氯代氨;NHCl2叫二氯代氨;
ClCH2COOH叫氯代乙酸。b.表示硫(或硒、碲)取代氧,如H2S2O3硫代硫酸;HSeCN叫硒代氰酸。
④聚 表示两个以上同种的分子互相聚合,如(HF)2叫二聚氟化氢,(HOCN)3叫三聚氰酸,(KPO3)6叫六聚偏磷酸钾。
(2) 基和根:基和根是指在化合物中存在的原子集团,若以共价键与其他组分结合者叫做
基,以电价键与其他组分结合者叫做根。基和根一般均从其母体化合物命名,称为某基或某根。基和根也可以用连缀其所包括的元素名称来命名,价已满的元素名放在前面,未满的放在后面。
见表1。
表l 基和根
母体化合物 | 基 | 根 |
NH3氨 | -NH2氨基 | NH4铵根 |
HOH水 | -OH羟基 | OH氢氧根 |
HCN氰化氢 | -CN氰基 | CN氢氰酸根 |
H2S硫化氢 | -SH巯基(氢硫基) | SH氢硫酸氢根 |
含氧酸 | 醯基 | 酸根 |
H2CO3碳酸根 | =O羰基、碳二醯 | CO3碳酸根,H2CO3碳酸氢 |
HNO3硝酸 | -NO硝基、硝醯 | NO3硝酸根 |
HNO2亚硝酸 | -NO亚硝基、亚硝醯 | NO2亚硝酸根 |
H2SO4硫酸 | -SO2OH磺酸基 | SO4硫酸根 |
=SO2硫醯 | H2SO4硫酸氢根 | |
H2SO3亚硫酸 | -SO2H亚磺基、亚硫醯 | SO3亚硫酸根 |
HSO3亚硫酸氢根 | ||
H3PO4磷酸 | -H2PO3磷酸一醯 | H2PO4磷酸二氢 |
=HPO2磷酸二醯 | HPO4磷酸氢根 | |
≡PO磷醯 | PO4磷酸根 | |
铀氧基盐 | =UO2铀醯 |
(3) 离子:元素的离子,根据元素名称及其化合价来命名。例如:Cl氯离子、Na钠离子带电的原子团,如上所述称为某根;若需指明其为离子时,则称为某离子或某根离子。 磷酸
磷酸
 磷酸
磷酸例如:HSO4一价硫酸根离子或称硫酸氢根离子;SiF6氟硅酸根离子;SO4硫酸根离子
(4)常用化学词冠:常用化学词冠(起修饰作用,以表达此物质的某一特点)见表2。
表2 化学词冠
词冠 | 含 义 | 举 例 |
正 | 表示此元素(原子或离子)显示着最常见的化合价态 | SnCl4氯化(正)锡,NiCl2氯化(正)镍 |
高 | 表示某元素的价态高于最常见的价态。 | Ni2O3氧化高镍,FeCl3氯化铁 |
亚 | 表示某元素的价态低于最常见的价态 | SnCl2氯化亚锡,FeO氧化亚铁 |
过 | 表示化合物里有过氧基或过硫基 | H2O2过氧化氢 |
多 | 表示化合物内某元素的原子数很多 | (NH4)2Sx多硫化铵 |
超 | 表示化合物中含有超氧基 | KO2超氧化钾 |
注:1.命名酸时,有一套专用的化学词冠,见“酸的命名法”。
2.过:-O-O-称为过氧基,-S-S-称为过硫基。如H-O-O-H称为过氧化氢。
3.高:表示某元素的价态高于最常见的价态。有时也用于表示某元素具有两种价态时,“高”显示着其中较高的价态
4.正:表示此元素(原子或离子)显示着最常见的化合价态(“正”字常省略)
二元化合物
(1) 二元化合物只含有两种元素的化合物叫做二元化合物。二元化合物的名称是在两种元素的名称中加化学介词“化”字缀合而成的。在名称中,阴性较强的元素名称放在前面,阳性较强的元素名称放在后面。化合物中两种元素的比例可以有两种方法表示:一种是标明阳电性组分的化合价;另一种是标明化学组成。为求每种二元化合物儘可能只用一种命名方法命名,特分别规定如下。
① 标明阳电性组分的化合价
a.极性二元化合物中,阳电性元素通常仅有一种化合价者,其阳电性元素的化合价不需另
加词头标明。例如:
NaCl 氯化钠A12O3氧化铝
CaCl2氯化钙 K2O 氧化钾
LiH MgS 硫化镁
b.极性化合物中,阳电性元素通常仅有两种化合价,而所形成的化合物其组成又与此两项变价之一相符。例如:Fe的化合物,FeO及Fe2O3就用此法命名.而Fe3O4则不用此法命名。
阳电性元素最常见的化合价,在名称中用词头“正”字表示,“正”字一般均予省略。低于常见化合价的价数用词头“亚”字表示,高于常见化合价的价数用词头“高”字表示。例如:
HgO 氧化汞 SnCl4氯化锡
Hg2O 氧化亚汞 SnCl2氯化亚锡
Fe2O3氧化铁 Co2O3氧化高钴
FeO 氧化亚铁CoO 氧化钴
CuCl2氯化铜 Ni2O3氧化高镍
CuCl 氯化亚铜NiO 氧化镍
② 标明化学组成
凡不属①法命名的二元化合物,都用此项方法命名。本类名词至少包括一个数字词头,当名称中有两个“一”字时就不能全部略去,而只可略去后一个“一”字。
例如一氧化一氮就只能简化成一氧化氮,不宜简化成氧化一氮,更不可简化成氧化氮。
a.非极性二元化合物都用此法命名。例如:
NO 一氧化氮B4C 一碳化四硼
N2O4四氧化二氮 N2O3三氧化二氮
N2O 一氧化二氮 FeP 一磷化铁
NO2二氧化氮 Fe2P 一磷化二铁
b.极性二元化合物中,阳性元素虽然通常仅有一种或两种化合价,但所形成的二元化合物其组成不符合常见的化合价时(如:AlCl,Fe3O4等),或其电价尚不清楚时(如:As2S2)也用此法命名。例如:
AlCl 一氯化铝FeS2二硫化铁AlO 一氧化铝Fe3S4四硫化三铁KO2二氧化钾 Cs2S4四硫化二铯K2O3三氧化钾 Cs2S5五硫化二铯Fe3O4四氧化三铁 Fe7S8八硫化七铁CaO4四氧化钙 Cs2S3三硫化二铯Sn4O9九氧化四钐 As4S4四硫化四砷

K2O4四氧化二钾 Cs2S6六硫化二铯
BaO4四氧化钡 As2S2二硫化二砷
c.化合价通常不止两种的阳性元素,其二元化合物用此法命名。例如:
MnO 一氧化(一)锰Mn2O7七氧化二锰
Mn2O3三氧化二锰 RuCl2二氯化钌
(2) 水溶液呈酸性的二元氢化物 水溶液是酸性的二元氢化物,除按一般二元化合物命名外,在水溶液中还可以视作无氧酸(也叫:氢酸),命名为氢某酸,但是它们的盐则仅能视作极性二元化合物命名,称为某化某。呈My(SH)x式的酸式氢硫酸盐宜称为氢硫化某。见表3。
例如,无氧酸的盐:
HgBr 溴化亚汞 HgS 硫化汞
KCl 氯化钾 Na2S 硫化钠 氯化钾
氯化钾
 氯化钾
氯化钾HgBr2溴化汞 MnCl2二氯化锰
MnCl3三氯化锰
表3 二元氢化物
化学式 | 视作一般二元化合物 | 视作无氧酸 | 化学式 | 视作一般二元 化合物 | 视作无氧酸 |
H2F2 | 氟化氢 | 氢氟酸 | HN3 | 叠氮化氢 | (氢)叠氨酸 |
HCl | 氯化氢 | 氢氯酸,盐酸 | HBr | 溴化氢 | 氢溴酸 |
H2S | 硫化氢 | 氢硫酸 | HI | 碘化氢 | 氢碘酸 |
HCN | 氰化氢 | 氢氰酸 |
酸式氢硫酸盐:
KSH 氢硫化钾Ba(SH)2氢硫化钡
(3) 过氧化物和过硫化物 仅含过氧基-O-O-和过硫基-S-S-的二元化合物可分别称为过氧化某和过硫化某。
H2O2、H-O-O-H 过氧化氢
Na2O2、Na-O-O-—Na 过氧化钠
Na2S2、Na-S-S-Na 过硫化钠
(4) 特定名称 十分重要的个别二元化合物,给予特定名称如下:
NH3氨 (CN)2氰
三元、四元等化合物
(1) 用特定的根基名称命名 三元、四元等化合物,若其组成的根基具有特定的名称时,则应在儘可能的情况下,採用二元化合物的命名法。例如:
KCN 氰化钾 Co(OH)3氢氧化高钴
BaSO4硫酸钡 SO2Cl2硫酸氯、氯化硫醯
SOCl2亚硫醯氯 SO2(NH2)2硫醯(二)胺、二氨基硫醯
SOClBr 亚硫醯溴氯、溴氯化亚硫醯NO2Cl 硝醯氯、氯化硝醯
Zn(NH2)2氨基(化)锌
(2) 命名的次序 几种阴电性组分同时与一种阳电性组分化合时,或几种阳电性组分同时与一种阴电性组分化合时,也应在儘可能的情况下,採用二元化合物的命名法,只是在名称中将阴性较强的组分名放在前面,阳性较强的组分名放在后面。这种名称中的数字词头,在不致误会时,可以略去。
混盐:BaClF氟氯化钡 CaClNO3氯化硝酸钙
ZrBr2Cl3二氯二溴化锆
复盐:KAl(SO4)2硫酸铝钾(NH4)2Fe(SO4)2硫酸亚铁铵
卤硫化物:SiSBr2二溴一硫化硅
卤氧化物:CrO2Cl2二氯二氧化铬、铬醯氯
VOCl 一氯一氧化钒
一氯一氧化钒
 一氯一氧化钒
一氯一氧化钒Mo2O3Cl5五氯三氧化二钼
MoO2Cl2二氯二氧化钼、钼醯氯
金属代铵化物:(NH2Hg2)Cl 氯代二亚汞铵
常见物质
二氧化碳
无色无臭气体,有酸味,溶于水(体积比1:1),部分生成碳酸。气体二氧化碳用于制硷工业、製糖工业,并用于钢铸件的淬火和铅白的製造等。可由碳在过量的空气中燃烧或使大理石、石灰石、白云石煅烧或与酸作用而得,是石灰、发酵等工业的副产品。二氧化碳一般不燃烧也不支持燃烧,常温下密度比空气略大,受热膨胀后则会聚集于上方,常被用作灭火剂。二氧化碳是绿色植物光合作用不可缺少的原料,温室中常用二氧化碳作肥料。固态二氧化碳俗称乾冰,升华时可吸收大量热,因而用作製冷剂,如人工降雨,也常在舞美中用于製造烟雾。 二氧化碳灭火器
二氧化碳灭火器
 二氧化碳灭火器
二氧化碳灭火器硫酸
纯硫酸是一种无色无味油状液体,溶解时放出大量的热,是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。化学性质为吸水性、脱水性、强氧化性、难挥发性、.酸性和稳定性。 硫酸
硫酸
 硫酸
硫酸稀硫酸,无色无嗅透明液体。化学性质为与多数金属(比铜活泼)氧化物反应,生成相应的硫酸盐和水; 与所含酸根离子氧化性比硫酸根离子弱的盐反应,生成相应的硫酸盐和弱酸; 与硷反应生成相应的硫酸盐和水; 与氢前金属在一定条件下反应,生成相应的硫酸盐和氢气; 加热条件下可催化蛋白质、二糖和多糖的水解。
氢氧化钠
纯的无水氢氧化钠为白色半透明,结晶状固体。氢氧化钠极易溶于水,溶解度随温度的升高而增大,溶解时能放出大量的热。它的水溶液有涩味和滑腻感,溶液呈强硷性,具备硷的一切通性。市售烧硷有固态和液态两种:纯固体烧硷呈白色,有块状、片状、棒状、粒状,质脆;纯液体烧硷为无色透明液体。氢氧化钠还易溶于乙醇、甘油;但不溶于乙醚、丙酮、液氨。对纤维、皮肤、玻璃、陶瓷等有腐蚀作用,溶解或浓溶液稀释时会放出热量;与无机酸发生中和反应也能产生大量热,生成相应的盐类;与金属铝和锌、非金属硼和硅等反应放出氢;与氯、溴、碘等卤素髮生歧化反应。能从水溶液中沉澱金属离子成为氢氧化物;能使油脂发生皂化反应,生成相应的有机酸的钠盐和醇,这是去除织物上的油污的原理。 氢氧化钠
氢氧化钠
 氢氧化钠
氢氧化钠氧化钙
性状:白色或带灰色块状或颗粒。对湿敏感。易从空气中吸收二氧化碳及水分。 溶于水成氢氧化钙并产生大量热,溶于酸类、甘油和蔗糖溶液,几乎不溶于乙醇。相对密度3.32~3.35。熔点2572℃。沸点2850℃。折光率1.838。有腐蚀性。
用途:1.可作填充剂,例如:用作环氧胶黏剂的填充剂;2.用作分析试剂,气体分析时用作二氧化碳吸收剂,光谱分析试剂,高纯试剂用于半导体生产中的外延、扩散工序,实验室氨气的乾燥及醇类脱l水等。3.用作原料,可製造电石、纯硷、漂白粉等,也用于製革、废水净化,氢氧化钙及各种钙化合物;4.可用作建筑材料、冶金助熔剂,水泥速凝剂,萤光粉的助熔剂;5.用作植物油脱色剂,药物载体,土壤改良剂和钙肥;6.还可用于耐火材料、乾燥剂;7.可配製农机1、2号胶和水下环氧胶黏剂,还用作与2402树脂预反应的反应剂;8.用于酸性废水处理及污泥调质;9.还可用作锅炉停用保护剂,利用石灰的吸湿能力,使锅炉水汽系统的金属表面保持乾燥,防止腐蚀,适用于低压、中压、小容量汽包锅炉的长期停用保护;10、可以和水反应製备氢氧化钙,反应方程式:CaO+H2O=Ca(OH)2,属于化合反应。
包装储运:1.运输注意事项:起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与易燃物或可燃物、酸类、食用化学品等混装混运。运输时运输车辆应配备泄漏应急处理设备。雨天不宜运输;2.储存注意事项:储存于阴凉、通风的库房。库内湿度最好不大于85%。包装必须完整密封,防止吸潮。应与易(可)燃物、酸类等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
硫酸铝
化学性质:极易溶于水,硫酸铝在纯硫酸中不能溶解(只是共存),在硫酸溶液中与硫酸共同溶解于水,所以硫酸铝在硫酸中溶解度就是硫酸铝在水中的溶解度。 常温析出含有18分子结晶水,为18水硫酸铝,工业上生产多为18水硫酸铝。含无水硫酸铝51.3%,即使100℃也不会自溶(溶于自身结晶水)。
不易风化而失去结晶水,比较稳定,加热会失水,高温会分解为氧化铝和硫的氧化物。加热至770℃开始分解为氧化铝、三氧化硫、二氧化硫和水蒸气。溶于水、酸和硷,不溶于乙醇。水溶液呈酸性。水解后生成氢氧化铝。水溶液长时间沸腾可生成硷式硫酸铝。工业品为灰白色片状、粒状或块状,因含低铁盐而带淡绿色,又因低价铁盐被氧化而使表面发黄。粗品为灰白色细晶结构多孔状物。无毒,粉尘能刺激眼睛。

氯化铜
蓝绿色斜方晶系晶体,有毒。在潮湿空气中易潮解,在乾燥空气中易风化。易溶于水,溶于醇和氨水、丙酮。其水溶液呈弱酸性。用于颜料、木材防腐等工业,、并用作消毒剂、媒染剂、催化剂。由于,氯化铜对皮肤有刺激作用,粉尘刺激眼睛,并引起结膜溃疡。所以,生产人员要穿工作服、戴口罩、手套等劳保用品,生产设备密闭,车间通风良好。 氯化铜
氯化铜
 氯化铜
氯化铜溴化物
可溶性的溴化物进入人体内后,离解出的溴离子,可加强大脑皮质的抑制过程,如Na、Br、KBr、NH4Br三者製成三溴合剂、对病人起镇静催眠的作用。 溴
溴
 溴
溴钾盐
KCl是可溶性钾盐,通过静脉滴注或口服进入体内,离解出的钾离子( 细胞外) 能与强心甙竞争受体,降低强心甙与其受体的亲和力,从而减轻或阻止强心甙毒性的发展,同时,钾离子本身还能降低心肌自律性,口服KCl溶液或静脉滴注,可以抗心律失常。
钙盐
钙盐主要有葡萄糖酸钙、氯化钙、乳酸钙等。
(1) 抗过敏作用,钙离子能降低毛细血管通透性、减少渗出,有助于减轻或缓解过敏症。
(2) 维持神经肌肉的正常兴奋性。正常人血清钙离子含量约9-11mg%,当血钙的浓度低于6-7mg%时,神经肌肉的兴奋性增高,可产生手足抽搐。此时静脉注射钙盐,可迅速缓解这种现象。
(3) 对心肌有兴奋作用:与洋地黄等联合用药时,能增加洋地黄的毒性,联合用药时要减量,以免增加毒性。此外,钙离子还参与血凝过程,高浓度的,与镁离子拮抗作用,可用于镁盐中毒的解救。
碳酸盐
又称小苏打,能够中和胃酸,从而解除胃酸的胃及十二指肠溃疡面的刺激和损伤,有利于溃疡的修复。但服用NaHCO3会使胃内压增高,对严重溃疡病患者,可能会引起穿孔,还有继发性胃酸增多的现象,故临床上一般不单独用NaHCO3治疗胃酸过多或胃溃疡。静脉注射NaHCO3可以治疗酸中毒,口服尚有硷化尿液的作用,与磺胺类合用,可防止其在泌尿道析出结晶,与链霉素合用治疗泌尿道感染时,以加强其抗菌作用,大量口服可引起硷中毒。
硫酸盐
包括MgSO4和NA2SO4。口服其盐类后,因不易吸收,使肠内渗透压升高,阻止肠道内水分的吸收,使肠内容物增多,刺激肠壁,使肠蠕动加强,引起排便,此类药物又称泻药,NA2SO4主要用于排除毒物,口服高浓度的MgSO4或用十二指肠导管直接注入十二指肠,因其对肠黏膜的刺激,反射性引起胆囊收缩,促进胆囊排空,有利胆作用。
铁製剂
铁製剂主要是用来治疗缺铁性血症,二价铁离子可被人体吸收,胃酸有助于亚铁离子的形成;维生素C,食物中的还原物质如果糖等有助于三价铁离子变成二价铁离子,促进铁的吸收,各种铁製剂中,以硫酸亚铁最为常用,吸收率较高,不良反应也较少,价格最便宜。
氧化亚氮
又名笑气,病人吸入可引起欣快感和麻醉状态,但必须和氧气合用(O2含量不低于20%),否则会由于缺氧而造成严重后果。又由于其麻醉药效不强,可作为其它麻醉药的诱导药或用于拨牙和分娩止痛。 氧化亚氮
氧化亚氮
 氧化亚氮
氧化亚氮含氧酸盐
(1) 简单含氧酸 每分子中仅含一个成酸元素的简单含氧酸,可将其在自由状态下较为常见者定名为(正)某酸,正字一般省略;其他各酸则视其中成酸元素的氧化值较正酸高、低多少,及其有无—O—O—结构,而採用一定词头来命名。
一个分子中成酸原子不止一个,而各成酸原子之间又系直接相连者,称为“连若干某酸”,在某酸的前面冠以相当的词头,下同。
由两个简单的一价醯基取代H—O—O—H中的氢而成的过酸,为含氧酸中常见的一种过酸,称为“过二某酸”。
由两个简单含氧酸缩去一分子水的同多酸甚为常见,除可按5命名为“一缩二某酸”外,一般均习用“焦”字作词头来命名,也有用“重(音chóng)”字作为词头命名的,如H2Cr2O7就命名为重铬酸。
设某元素最常见的含氧酸(即正酸)的化学式为HmXOn,,其中x的氧化值等于2n—m,则此元素的其他简单含氧酸,可按其化学式和结构分别加上下列词头来命名(表4,表5)。
①偏自一个分子正酸缩去一分子水而成的酸,定名为偏酸。也可以称做一缩(一)正某酸,其中“一”和“正”两字通常均予略去。表4分子中仅含一个原子成酸元素的简单含氧酸
成酸元素的氧化值 | 化 学式 | 词头 | 例解 | ||||
(2n-m)+2 | HmXOn+1(有-O-O-结构) | 过 | HNO4 | H3PO5 | H2SO6 | ||
(2n-m)+2 | HmXOn+l(无-O-O-结构) | 高 | HClO4 | ||||
(2n-m)+1 | Hm-1XOn(均无-O-O-结构) | 高 | HMnO4 | ||||
2n-m | HmXOn | (正) | H2MnO4 | HClO3 | HNO3 | H3PO4 | H2SO4 |
(2n-m) -2 | HmXOn一1 | 亚 | H4MnO4 | HClO2 | HNO2 | H3PO3 | H2SO3 |
(2n-m) -3 | Hm+1XOn一1 | 次 | H2NO2 | ||||
(2n-m) -4 | HmXOn-2 | 次 | HClO | H3PO2 | H2PO2 | ||
成酸元素的价数 | 化 学式 | 词 头 | 例 | 解 |
2n-m | Hm-1On-1XOXOn-1Hm-1 | (一缩)二,焦,重 | H 4P2O7 | H2S2O7 |
2n-m-2 | Hm-lOn-2XOXOn-2Hm-1 | (一缩)二亚 | H4P2O5 | H2S2O5 |
2n-m | Hm-1On-lXXOn-1Hm-1 | 连二 | H4P2O6 | H2S2O6 |
2n-m-2 | Hm-1On-2XXOn-2Hm-1 | 连二亚 | H2S2O4 | |
2H-m-3 | HmOn-2XXOn-2Hm | 连二次 | H2N2O2 | |
2n—m | Hm-1On-1XXs-2XOn-lHm-1 | 连多 | H2S2O6 | |
2n—m | Hm-1On-1XOOXOn-1Hm-1 | 过二 | H4P2O8 | H2S2O8 |
①此处Xs-2中的X均为二价,而其他两个X的化合价为2n-m。
②原酸分子中氢氧基的数目和成酸元素的氧化值相等时,可用词头“原”字来表示。称为“原某酸”。原酸或以自由状态存在,或以盐或酯的形式存在。例如:
H4CO4原碳酸 H6TeO6原碲酸
H4SO6原硫酸 H4SiO4原硅酸
H5PO5原磷酸
③硫代的含氧酸中用硫原子(S)代替氧原子(O)而得的酸,通称为硫代酸,分别叫做“几硫代某酸”,其中“几”为“一”字时可以省去。其他硫属取代氧的酸,可以依此而命名为硒(碲)代某酸。例如:
H2S2O3硫代硫酸 HSCN 硫(代)氰酸
H2CS3三硫代碳酸 HSeCN 硒(代)氰酸
④铁的含氧酸:理论上存在的铁的含氧酸HFeO2及H2FeO4分别命名为(正)铁酸和高铁酸,其盐则分别称为(正)铁酸盐和高铁酸盐。
(2)酸酐和醯基:简单含氧酸完全脱水后形成的二元氧化物,除了可按二元化合物命名外,还可以依从原来的酸名,命名为某(酸)酐。例如:
化学式 视作二元化合物视作某酸酐
CO2 二氧化碳 碳(酸)酐
N2O5 五氧化二氮 硝(酸)酐
N2O3 三氧化二氮 亚硝(酸)酐
SO3 三氧化硫 硫(酸)酐
SO2 二氧化硫 亚硫(酸)酐
简单的含氧酸脱去氢氧基后余下的基叫做醯基,醯基从原来的酸名命名。若酸中全部氢氧基均已除去,就叫做某醯(基);若仅除去一部分氢氧基,则命名为某酸几醯(基),几指除去的氢氧基数目而言,基字通常可省(—SO2OH和—SOOH则另定名称为磺基与亚磺基)。例如:
SO2— 硫(酸)醯(基)CrO2— 铬(酸)醯基
Cr(OH)O2— 铬酸一醯(基) VO2— 钒(酸)醯基
WO2— 钨(酸)醯基
(3)取代含氧酸 其他基取代含氧酸中氢氧基后形成的酸叫做取代含氧酸,一般均从原来的酸命名为几某基某酸,一字均予省略,基字最好不省略。仅以含—SO3H者称做某磺酸;含一SO2H者叫某亚磺酸。例如:
NH2PO(OH)2氨基磷酸 Cl·SO2·OH 氯基磺酸
(NH2)2P2O3(OH)2氨基焦磷酸 NH2·SO·OH 氨基亚磺酸
ClCrO2(OH) 氯基铬酸 NH2·SO2·OH 氨基磺酸
(4)简单含氧酸盐
①中式盐酸中能电离的氢全部被金属根或阳电性根取代而成的中式盐,命名为某酸某(金属)。
在含氧酸盐名称中,化合价通常恆定的金属元素,其价数不必标明;化合价通常仅有两种的金属元素,其价数用亚、(正)、高等词头来标明,和二元化合物所规定的相同。
化合价通常不止两种的金属元素,其价数一般用一价、二价、三价等词头标明。但是为了使这些金属元素常见的含氧酸盐名称能够简明起见,特对下述金属元素的某些常见价数规定用亚、(正)或高等词头标明,且正字通常省略。
锰:二价为正。
铂:二价为亚,四价为正。
稀土金属:二价为亚,三价为正,四价为高。
例如,无变价者:
Na2CO3碳酸钠ZnSO4硫酸锌
AlAsO4砷酸铝
通常仅有两种变价者:
Cu2CO3碳酸亚铜CuCO3碳酸铜 碳酸铜
碳酸铜
 碳酸铜
碳酸铜FeSO4硫酸亚铁Fe2(SO4)3硫酸铁
CoSO4硫酸钴Co2(SO4)3硫酸高钴
PbSO4硫酸铅Pb(SO4)2硫酸高铅
化合价通常不止两种者:
MnSO4硫酸锰Mn2(SO4)3硫酸三价锰
稀土金属:
Ce(SO4)2硫酸高铈Ce2(SO4)3硫酸铈
变价金属的价数也可以在相应的元素名称后加带括弧的罗马数字来标明。如上述两种化合物可依次称为:硫酸铈(Ⅳ)、硫酸铈(Ⅲ)。
②酸式盐与硷式盐酸式盐中的氢用“氢”字表示,羟基盐中的氢氧基用“羟”来表示。氧基盐中的氧用“氧化”表示。“氢”、“羟”、“氧化”等字均置于金属名前,其数目用一、二、三等词头表示,一字通常省略。
常见的、在水溶液中稳定的阳离子的氧化金属根,给予下列特定名称;其盐除可按上述氧基盐命名法命名外,尚可按此项特定名称来命名。
氧化金属根的名称如下,其中“一”字可省略,“二”字不可省略。
HfO铪氧根UO铀(一)氧根
MoO2钼二氧根UO2铀二氧根
TiO钛氧根ZrO锆氧根
ThO钍氧根WO钨氧根
如果金属元素具有不同的氧化数,应该在金属的名称后面用加圆括弧的罗马数字标明其氧化
数。氧化金属根的化合价,则在其名称的后面用加括弧的阿拉伯数字;或在其化学符号的右上角
用阿拉伯数字来标明。例如MoO钼(Ⅲ)氧根(1+);MoO钼(Ⅴ)氧根(3+)。
例如,酸式盐:
NaH2PO4磷酸二氢 Na2HPO4 磷酸二氢钠
磷酸二氢钠 磷酸氢二钠
磷酸氢二钠
 磷酸二氢钠
磷酸二氢钠 磷酸氢二钠
磷酸氢二钠硷式盐:a.氧基盐
化学式 一般命名 用特定根名命名
BiONO3 硝酸氧化铋 硝酸氧铋
(SbO)2SO4硫酸二氧化二锑 硫酸氧锑
(VO2)2SO4硫酸四氧化二钒 硫酸双氧钒
(UO)2SO4硫酸二氧化二铀 硫酸氧铀
(UO)2(ClO4)2高氯酸二氧化铀 高氯酸双氧铀
(VO)SO4 硫酸氧化钒 硫酸(二价)氧钒
b.羟基盐
Cu(OH)IO4 碘酸羟铜
V(OH)2(SO4)3硫酸二羟二钒(V)
複杂的酸式盐和硷式盐,在用上述方法命名时,若根据其他根基的数目可以算出酸根的数目,则通常都略去表示酸根数目的词头,因为几某酸之类的名称容易和同多酸盐的名称相混。
複杂的酸式盐或硷式盐还可以视作分子化合物来命名,将酸或硷的名称放在前面,盐的名称放在后面,中间用化学介词“合”字连缀来命名。分子的数目用一、二、三等词头来标明,并在名称的后面附上化学式,但是当确定它的结构是属于配位化合物时,则应按配位化合物来命名
表6 命名方法
化学式 | 用氢字命名 | 视作分子化合物 | 类 名 |
複杂的酸式盐: | |||
KIO3·2HIO3=KH2(IO3)3 | 碘酸二氢钾 | 二(碘酸)合碘酸钾 | 酸式碘酸钾 |
4K2SO4·3H2SO4=K8H6(SO4)7 | 硫酸六氢八钾 | 三(硫酸)合四(硫酸钾) | 酸式硫酸钾 |
5K2SO4·3H2SO4=K5H3(SO4)4 | 硫酸三氢五钾 | 三(硫酸)合五(硫酸钾) | 酸式硫酸钾 |
複杂的硷式盐: | |||
CuCO3·Cu(OH)2 | 碳酸二羟铜 | 氢氧化铜合碳酸铜 | 硷式碳酸铜 |
Al2(SO4)a·Al(OH)3=Al(OH)SO4 | 硫酸羟铝 | 氢氧化铝合硫酸铝 | 硷式硫酸铝 |
SnO·SnCO3 | 碳酸氧化亚锡 | 氧化亚锡合碳酸亚锡 | 硷式碳酸亚锡 |
③混盐和复盐 混盐和复盐可依照3(2)的规定命名,当有几个电负性时,在名称中将电负性较强者放在前面;有几个电正性组分同时存在时,在名称中者放在前面。混盐和复盐也可视作分子化合物来命名,在名称中将分子量较小者放
混盐 例:
Ca(NO3)Cl 氯化硝酸钙 NH4MgPO4磷酸镁铵
Ca(OCl)Cl 氯化次氯酸钙KCaP4磷酸钙钾
KNaCO3碳酸钠钾
复盐 例:
KCl·MgCl2·6H2O 六水合氯化镁氯化钾,俗名光卤石
Fe(NH4)2(SO4)2硫酸亚铁铵
或FeSO4·(NH4)2SO4硫酸铵合硫酸亚铁
其他
同多酸与同多酸盐、杂多酸与杂多酸盐
(1)同多酸 由两个或两个以上同种简单含氧酸分子缩水而成的酸叫做同多酸,命名方法是:由r分子正某酸HmXOn(或原某酸HmXOn)缩去q分子水而成的同多酸,称为“q缩r某酸”(或q缩r原某酸)。
焦酸(重酸)也可以说是属于同多酸之列,但因为比较简单而常见,所以在简单含氧酸中已述及了。
(2)同多酸盐它有两种命名法。
①按照同多酸的名称,称为“几缩几某酸几某”(或几缩几原某酸几某);因为阳离子数已注明,所以几缩二字可以省去。此命名法常用。
②将同多酸盐按比例解析成为酸酐或硷酐来命名。在名称中将酸酐与硷酐的比例用阿拉伯数字表示,写在名称前的方括弧中,名称为[X:Y]某酸某。例如:
实验式按①法命名 解析式按②法命名
Na4B2O5(一缩)二硼酸四钠 2Na2O·B2O3[1:2]硼酸钠
Na2Mo2O7(一缩)二钼酸二钠 Na2O·2MoO2[2:1]钼酸钠
Na4V2O7焦钒酸钠、(一缩)二钒酸四钠 2Na2O·V2O5[1:2]钒酸钠
Na2B4O7(五缩)四硼酸二钠 Na2O·2B2O [2:1]硼酸钠
Na2W2O7(一缩)二钨酸二钠 Na2O·2WO3[2:1]钨酸钠
(3)杂多酸杂多酸命名有两种方法。两法都是将杂多酸解析为水、成酸的金属氧化物及非金属或两性金属所成的酸,并据此命名。但以阿拉伯数字在名前记出其数目比
细胞中的
水是活细胞中含量最多的化合物。不同种类的生物体中,水的含量不同;不同的组织、器官中,水的含量也不同。
细胞中水的存在形式有自由水和结合水两种,结合水与其他物质相结合,是细胞结构的重要组成成分,约占4.5%;自由水以游离的形式存在,是细胞的良好溶剂,也可以直接参与生物化学反应,还可以运输营养物质和废物。总而言之,各种生物体的一切生命活动都离不开水。
细胞内无机盐大多数以离子状态存在,其含量虽然很少,但却有多方面的重要作用:有些无机盐是细胞内某些複杂化合物的重要组成成分,如Fe是血红蛋白的主要成分,Mg是叶绿素分子必需的成分;许多无机盐离子对于维持细胞和生物体的生命活动有重要作用,如血液中钙离子含量太低就会出现抽搐现象;无机盐对于维持细胞的酸硷平衡也很重要。
 读书笔记摘抄新闻资讯
读书笔记摘抄新闻资讯