Lewis酸硷理论
路易斯酸硷理论(Lewis acids and bases),又称酸硷电子理论,由美国物理化学家吉尔伯特·路易斯(Gilbert N.Lewis)提出。 1923年的酸硷质子理论大大扩展了酸硷範围并得到广泛套用,但它把酸仍然限制在含氢的物质上,而在酸硷质子理论提出的同年,吉尔伯特·路易斯提出了更广义的酸硷电子理论。
基本介绍
- 中文名:路易斯酸硷理论
- 外文名:Lewis acids and bases
- 别称:酸硷电子理论
- 提出者:吉尔伯特·牛顿·路易斯
- 提出时间:1923年
- 套用学科:物理、化学
基本观点
酸硷电子理论认为:凡能接受电子对的物质(分子、离子或原子团)都称为酸,凡能给出电子对的物质(分子、离子或原子团)都称为硷。酸是电子对的受体,硷是电子对的给体 ,它们也称为路易斯酸和路易斯硷。酸硷反应的实质是硷提供电子对与酸形成配位键, 反应产物称为酸硷配合物。
理论发展
布朗斯特酸硷理论概念的核心繫于分子或离子间的质子转移,显然无法对不涉及质子转移,但却具有酸硷特徵的反应做解释.这一不足在布朗斯特概念提出的同年由美国化学家路易斯提出的另一个更广的酸硷概念所弥补,但后者直到20世纪30年代才开始在化学界产生影响. lewis.G.N
lewis.G.N
 lewis.G.N
lewis.G.N酸硷电子理论(the electronic theory of acid and alkali),也称广义酸硷理论、路易斯(lewis)酸硷理论,是1923年美国物理化学家吉尔伯特·牛顿·路易斯(Lewis G N)提出的一种酸硷理论,它认为:凡是可以接受外来电子对的分子、基团或离子为酸;凡可以提供电子对的分子、离子或原子团为硷。这种理论包含的酸硷範围很广。
电子酸硷
该理论认为:
凡是能够接受外来电子对的分子、离子或原子团称为路易斯酸(Lewis acid),即电子对接受体,简称受体;
凡是能够给出电子对的分子、离子或原子团称为路易斯硷(Lewis base),即电子对给予体,简称给体。
或者说:
路易斯酸(Lewis acid)是指能作为电子对接受体(Electron pair acceptor)的原子,分子,离子或原子团;
路易斯硷(Lewis base)则指能作为电子对给予体(Electron pair donor)的原子,分子,离子或原子团;
酸硷反应是电子对接受体与电子对给予体之间形成配位共价键的反应。
路易斯酸的分类
1、 配位化合物中的金属阳离子。
2、有些分子和离子的中心原子儘管满足了8电子结构,仍可扩大其配位层以接纳更多的电子对。
3、另一些分子和离子的中心原子也满足8电子结构,但可通过价层电子重排接纳更多的电子对。
4、某些闭合壳层分子可通过其反键分子轨道容纳外来电子对。碘的丙酮溶液呈现特有的棕色,是因为 分子反键轨道接纳丙酮中氧原子的孤对电子形成配合物。
分子反键轨道接纳丙酮中氧原子的孤对电子形成配合物。
常见的Lewis酸:
1、正离子、金属离子:钠离子、烷基正离子、硝基正离子
2、受电子分子(缺电子化合物):三氟化硼、三氯化铝、三氧化硫、二氯卡宾
在有机化学中Lewis酸是亲电试剂
路易斯硷的分类
1、 阴离子;
2、具有孤对电子的中性分子如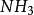 ;
;
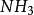
3、含有碳-碳双键的分子。
Lewis硷显然包括所有Bronsted硷,但Lewis酸与Bronsted酸不一致,如HCl是Bronsted酸,但不是Lewis酸,而是酸硷加合物。
常见的Lewis硷:
1、负离子:卤离子、氢氧根离子、烷氧基离子、烯烃、芳香化合物
2、带有孤电子对的化合物:氨、氰、胺、醇、醚、硫醇、二氧化碳
在有机化学中Lewis硷是亲核试剂
注意:
1、Lewis酸硷电子理论中只有酸、硷和酸硷络合物,没有盐的概念;
2、在酸硷电子理论中,一种物质究竟属于硷,还是属于酸,还是酸硷配合物,应该在具体反应中确定。在反应中起酸作用的是酸,起硷作用的是硷,而不能脱离具体反应来辨认物质的酸硷性。同一种物质,在不同的反应环境中,既可以做酸,也可以做硷;
3、正离子一般起酸的作用,负离子一般起硷的作用;
4、这一理论的不足之处在于酸硷的特徵不明显。
理论不足
酸硷电子理论扩大了酸硷範围,可把酸硷概念用于许多有机反应和无溶剂反应。这是它的优点。它的缺点是这一理论包罗万象,使酸硷特徵不明显,同时,如果选择不同的反应对象,酸或硷的强弱次序也可能不同,它对确定酸硷的相对强弱来说,没有统一的标度,对酸硷的反应方向难以判断。后来,皮尔逊提出的软硬酸硷理论弥补了这种理论的缺陷。
 读书笔记摘抄新闻资讯
读书笔记摘抄新闻资讯