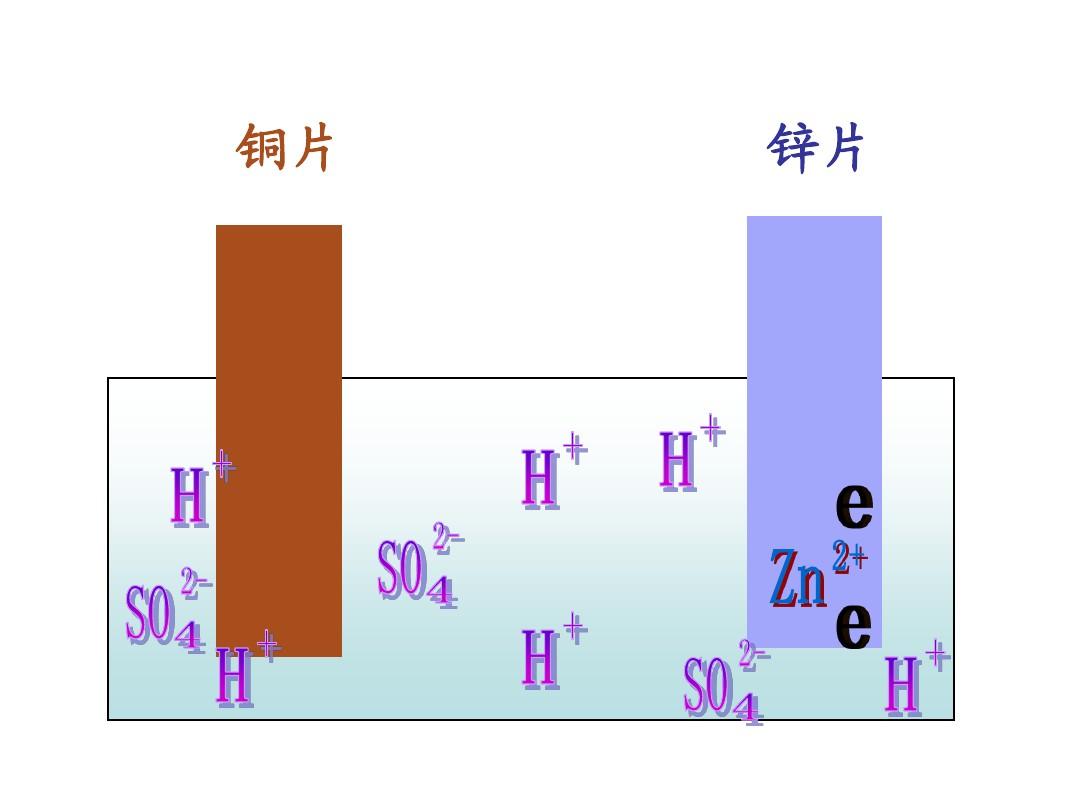
铜锌原电池
铜、锌两电极,一同浸入稀硫酸时,由于锌比铜活泼,容易失去电子,锌被氧化成二价锌进入溶液,电子由锌片通过导线流向铜片,溶液中的氢离子从铜片获得电子,被还原成氢原子。
基本介绍
- 中文名:铜锌原电池
- 外文名:Copper-zinc primary battery
- 材质:铜 锌 H2SO4
- 分类:电池
- 正电极:铜
- 负电极:锌
- 电解质溶液:稀硫酸
原理
氢原子结合成氢分子从铜片上放出。两极发生如下反应:
正极:2H+ +2e-=H2↑(稀硫酸溶液为电解质溶液)
负极:Zn-2e-=Zn2+
总反应式:Zn+2H+=Zn2++H2↑
方法一
实验仪器及用品
试管,镊子,铜棒,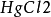 ,0.1mol·L-1硫酸溶液
,0.1mol·L-1硫酸溶液
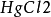
操作
取一试管并斜放入一大粒纯锌(如没有纯锌可将粗锌泡在饱和的氯化汞溶液中,用镊子夹出沖洗净),再倒入0.1mol·L-1硫酸溶液,观察表面逸出气泡情况。
 锌铜原电池
锌铜原电池在盛有纯锌和0.1mol·L-1硫酸溶液中,用一根纯铜棒插在纯锌的表面上,可以观察到在锌表面气泡很少,而在插进液面中铜棒四周气泡很多。(如图)
结论
铜表面气泡来源不可能是铜与稀硫酸反应,而是锌丢失的电子同遇到溶液中的氢离子发生了反应。可以推知锌流出电子,在流经铜导线时,将电子转移给铜四周的氢离子。
方法二
实验仪器及用品
烧杯、锌板、铜板、电流计、导线、0.1mol·L-1硫酸溶液
操作
用一个烧杯、盛入0.1mol·L-1的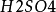 溶液后,用固定锌、铜两电极的插座,把锌和铜两个电极浸泡在0.1mol·L-1
溶液后,用固定锌、铜两电极的插座,把锌和铜两个电极浸泡在0.1mol·L-1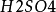 中,再用电流计和导线把两级连线好。
中,再用电流计和导线把两级连线好。
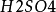
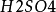
现象
除铜极有氢逸出外,在电流计中还可以看到指针发生偏转,表示有电流产生。
注意


1.如果接通后,导线串连的电流计指针不发生偏转,或是瞬息偏转,都是失败的现象。在溶液与电极接触处如铜极无气体产生时,这也是失败的现象。
2.纯锌片若不好找到,可将粗锌置饱和氯化汞溶液中浸泡,用镊子取出,再经沖洗后可以使用。防止用手接触溶液,实验后一定要用肥皂洗手。
方法三
实验仪器及用品
烧杯,KCl盐桥,1mol·L-1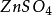 溶液,1mol·L-1
溶液,1mol·L-1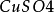 溶液,锌极板,铜极板,电流计,导线
溶液,锌极板,铜极板,电流计,导线
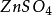
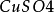
操作
如图,在两烧杯中分别盛有(1)1mol·L-1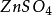 溶液和(2)1mol·L-1
溶液和(2)1mol·L-1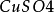 溶液,(3)为琼脂和饱和氯化钾溶液的盐桥。操作和现象同之二所述。
溶液,(3)为琼脂和饱和氯化钾溶液的盐桥。操作和现象同之二所述。
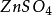
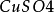
注意
1.铜片面积大一些,便于观察。锌片纯一些,可以减少锌片上的气泡。
2.电流计可以用发光二极体或导电仪代替用发光来检测电流通过。
形成条件
- 活动性不同的两个金属(或其中一种为非金属,即作导体作用)作电极
- 电极均插入电解质溶液
- 必须有闭合的迴路
反应本质
氧化还原反应
判断方法
微观判断:
①根据电子流动方向
电子流出的极——负极
电子流入的极——正极
巨观判断:
②根据电极材料
较活泼的电极材料——负极
较不活泼的电极材料——正极
③根据原电池电极发生的反应
发生氧化反应的极——负极
发生还原反应的极——正极
组成
组成 | 负极 | 正极 | 电解质液 |
电极材料 | 能导电的物质 | 酸溶液 硷溶液 盐溶液 熔融液 | |
电极上发生反应的物质 | 还原性较强的物质(多是金属电极本身) | 氧化性较强的物质 | |
电子流向 | 流出电子 | 流入电子 | |
反应类型 | 氧化反应 | 还原反应 | |
 读书笔记摘抄新闻资讯
读书笔记摘抄新闻资讯