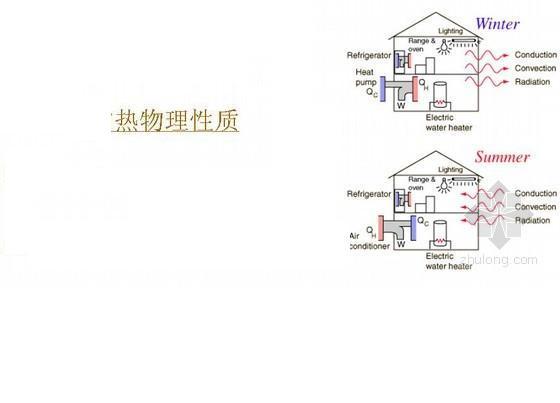
热物理性质
热学是物理学的一个重要部分。它专门研究热现象的规律及其套用。对热现象的研究:一是由观察和实验入手,总结出热现象规律,构成热现象的巨观理论,叫做热力学;二是从物质的微观结构出发(即以分子、原子的运动和它们之间的相互作用出发),套用统计方法去研究热现象的规律,构成热现象的微观理论,叫做统计物理学。
基本介绍
- 中文名:热物理性质
- 外文名:Thermal physical properties
- 分类:一、热力学 二、统计物理学
简介
热的概念来自人们对冷热的感觉。它是物质运动表现的形式之一。它的本质是大量的实物粒子(分子、原子等)永不停息地作无规则的运动。热与实物粒子的无规则运动的速度有关,无规则运动越强烈时,则该物体或系统就越热,温度也越高。热的另一种涵义是热量,热量是能量变化的一种量度。热量与温度的概念不同,不能混为一谈。热运动是物质的一种运动形式。巨观物体内部大量微观粒子(如分子、原子、电子等)永不停息的无规则运动称为热运动。它是物质的一种基本运动形式。一个物体或某一系统在热平衡时的温度,取决于他内部微观粒子热运动的状况,热运动越剧烈,它的温度就越高。凡与温度有关的物质系统性质的变化,统称为“热现象”
分类
热力学和统计物理学研究对象是一致的,都是研究物体内部热运动的规律性以及热运动对物体性质的影响,但是研究的方法截然不同。热力学根据观察和实验所总结出来的热力学定律,以严密的逻辑推理来研究巨观物体的热性质,它不涉及物质的微观结构。统计物理学则从物质的微观结构出发,依据每个粒子所遵循的力学规律,用统计学的方法研究巨观物体的热性质。热力学对热现象给出可靠的依据,用以验证微观理论的正确性;统计物理学可深入探讨热现象的本质,使热力学的理论获得更深刻的意义。因此这两种方法,起到了相辅相成的作用,使热现象的研究更加深入。
热力学
它是研究热现象中物态转变和能量转换的学科。由观察和实验总结出热现象的规律,构成热现象的巨观理论。在19世纪中叶,焦耳等人通过多次实验,将热确定为能的一种形式,从而建立了热力学。热力学的研究是从大量经验中总结了自然界有关热现象的一些共同规律而得出热力学定律(即热力学第零、第一、第二和第三定律),用严密的逻辑推理来研究巨观物体的热性质及规律。通常是将热力学第一定律及第二定律视作热力学的基本定律,但有时增加能斯特定理当作第三定律,又有时将温度存在定律当作第零定律。一般将这四条热力学规律统称为热力学定律。热力学是热现象的巨观理论,它是以这四条定律为基础建立起来的理论。
热力学第零定律
若两个热力学系统中的任何一个系统都和第三个热力学系统处于热平衡状态,那幺,这两个热力学系统也必定处于热平衡。这一结论称做“热力学第零定律”。热力学第零定律的重要性在于它给出了温度的定义和温度的测量方法。定律中所说的热力学系统是指由大量分子、原子组成的物体或物体系。它为建立温度概念提供了实验基础。这个定律反映出:处在同一热平衡状态的所有的热力学系统都具有一个共同的巨观特徵,这一特徵是由这些互为热平衡系统的状态所决定的一个数值相等的状态函式,这个状态函式被定义为温度。而温度相等是热平衡之必要的条件。因此,这一基本物理量实质是反映了系统的某种性质。
在热力学第一定律建立以前,人们曾幻想製造出一种永动的机器,不需要任何燃料和动力,又不消耗系统本身的内能,却能不断对外做功而且永远运转,这类机器叫“第一类永动机”。根据能的转化与守恆定律,系统在对外做功过程中,它的内能要减小,要想不减少它的内能,外界必须同时对它传递热量或对它做功,不断地给系统补充能量,系统才能持续不断地对外做功。这种违背能量守恆与转化定律的器械,也就是违背热力学第一定律的器械永远也不可能製造成。
热力学第一定律
是热力学的基本定律之一。是能的转化与守恆定律在热力学中的表现。它指出热是物质运动的一种形式,并表明,一个体系内能增加的量值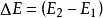 等于这一体系所吸收的热量Q 与外界对它所做的功之和,可表示为
等于这一体系所吸收的热量Q 与外界对它所做的功之和,可表示为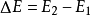
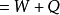 即
即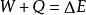 。在这个公式中,突出了做功和热传递是改变系统内能的两种不同形式,可通过做功和被传递的热量来量度系统内能的变化。在上述公式中,当外界对系统作功时,W为正值;若系统对外作功时,W 为负值。如外界向系统传热,Q 即为正值;若系统向外界放热,则Q 为负值。当△E 为正值时,表示系统的内能增加;如果△E 为负值时,则表现系统的内能在减少。对热力学第一定律也可以从另一侧面来描述,即外界传递给系统的热量等于系统内能的增量和系统对外所作的功的总和。如果外界传递给系统的热量为Q,使系统从某一平衡状态到达另一平衡状态,内能的增加为
。在这个公式中,突出了做功和热传递是改变系统内能的两种不同形式,可通过做功和被传递的热量来量度系统内能的变化。在上述公式中,当外界对系统作功时,W为正值;若系统对外作功时,W 为负值。如外界向系统传热,Q 即为正值;若系统向外界放热,则Q 为负值。当△E 为正值时,表示系统的内能增加;如果△E 为负值时,则表现系统的内能在减少。对热力学第一定律也可以从另一侧面来描述,即外界传递给系统的热量等于系统内能的增量和系统对外所作的功的总和。如果外界传递给系统的热量为Q,使系统从某一平衡状态到达另一平衡状态,内能的增加为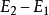 ,同时对外作功W′,则热力学第一定律可表示为
,同时对外作功W′,则热力学第一定律可表示为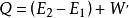 即
即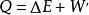 。在这个公式中,当系统从外界获得热量时,Q>0为正值;而当系统向外界释放热量时, Q0为正值;若外界对系统作功,W′<0为负值。在系统内能增加时,△E 为正值,若系统的内能减少时,则△E 为负值。
。在这个公式中,当系统从外界获得热量时,Q>0为正值;而当系统向外界释放热量时, Q0为正值;若外界对系统作功,W′<0为负值。在系统内能增加时,△E 为正值,若系统的内能减少时,则△E 为负值。
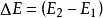
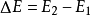
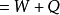
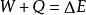
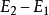
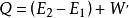
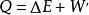
热力学第二定律
热力学的基本定律之一。它是关于在有限空间和时间内,一切和热运动有关的物理、化学过程具有不可逆性的总结。克劳修斯、开尔文等人,从将热转变为功时遇到的经验归纳成热力学第二定律。它实质上指出了巨观热现象的不可逆性。它的表述有很多种,但实际上都是互相等效的。如下列几种表述:
克劳修斯表述:克劳修斯在1850年提出的。热量总是自动的从高温物体传到低温物体,不可能自动地由低温物体向高温物体传递。在它的表述中,指出在自然条件下热量只能从高温物体向低温物体转移,而不能由低温物体自动向高温物体转移,这个转变过程是不可逆的。若想让热传递方向逆转,则必须消耗功才能实现。
2.开尔文表述:开尔文在1851年提出的。不存在这样一种循环过程,系统从单一热源吸取热量,使之完全变为有用功而不产生其他影响。表述中的“单一热源”是指温度均匀并且恆定不变的热源;“其他影响”指除了由单一热源吸热,把所吸的热用来作功以外的任何其他变化。若有其他影响产生时,把由单一热源吸来的热量全部用来对外作功是可能的。自然界中任何形式的能都可能转变成热,但热却不能在不产生其他影响的条件下完全变成其他形式的能,这种转变在自然条件下也是不可逆的。热机在运行过程中,可连续不断地将热变为机械功,一定伴随有热量的损失。第二定律和第一定律两者有所不同。第二定律阐明了过程进行的方向性。
根据热力学第零定律,确定了态函式——温度;根据热力学第一定律,确定了态函式——内能和焓;根据热力学第二定律,也可以确定一个新的态函式——熵。可以用熵来对第二定律作定量的表述。
热力学第二定律在引入熵的概念后,可用数学形式表示。其积分形式为
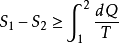
式中不等号对应于不可逆过程,等号对应于可逆过程,角码1和2分别表示系统的初状态和末状态,S 表示系统的熵。热力学第二定律的微分形式
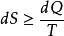
热力学第三定律
此定律指出,构想通过几个有限的步骤使物体冷却到绝对零度,是不可能的。这一表述是能斯脱于1912年根据对低温现象的研究得出能斯脱定理的推论。
统计物理学
是用统计方法研究由大量微观粒子组成的物质系统内部热运动规律及其对系统性质的影响。它是从物质的微观结构,即从分子、原子的运动和它们之间的相互作用出发,来研究热现象的规律,构成热现象的微观理论。统计物理学的前身是气体分子运动论。统计物理学是从巨观系统内部的微观结构出发,根据微观粒子所遵从的力学规律,用统计方法,将系统的巨观性质及其变化规律推导出来。所以,统计物理学与热力学两者之间可以相互补充。
理想气体
把严格服从波义耳-马略特定律、盖·吕萨克定律和查理定律的想像的气体,称为“理想气体”。气体分子运动论的研究对象主要是气体物质系统。在通常情况下,气体中的分子本身所占的体积,比起气体分子所能自由活动的空间,即气体的体积是小得多的,所以分子本身的大小可忽略不计。例如,在温度为0℃、压强为1大气压下的气体,其密度不到液体的密度的千分之一。在某种情况下忽略气体分子本身的大小对我们研究的问题影响并不大。若在高温低压的情况下,将气体分子本身的大小忽略掉,则影响就更小。至于气体分子之间的相互作用力,由于它随着分子之间距离的增大而迅速地减小,故在一般常温、常压下,也可忽略不计气体分子之间存在着的分子力。也就是说,除了气体分子之间发生碰撞的瞬间之外,可认为气体分子之间是没有相互作用的。此外,也不考虑气体分子的内部结构,即认为分子在碰撞过程中不发生形变。若将气体分子视为刚体,而分子间的碰撞又是完全弹性碰撞,那幺,气体分子就遵守动量守恆和动能守恆定律。符合上述要求的气体即称为理想气体。在通常的温度和压强下,理想气体和实际气体的性质差别并不太大。因此,所有的实际气体在温度不太低、压强不太大的情况下,都可近似地看作理想气体。
玻义耳-马略特定律:
它反映气体的体积随压强改变而改变的规律。对于一定质量的气体,在其温度保持不变时,它的压强和体积成反比;或者说,其压强P 与它的体积V 的乘积为一常量,即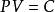 (常数)(T 不变时)或
(常数)(T 不变时)或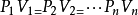 式中常量的大小与气体系统的温度和气体的质量有关。实际气体只是在压强不太高、温度不太低的条件下才服从这一定律。
式中常量的大小与气体系统的温度和气体的质量有关。实际气体只是在压强不太高、温度不太低的条件下才服从这一定律。
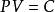
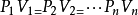
盖·吕萨克定律:
它反映了气体体积随温度变化而变化的规律。一定质量的气体,在保持压强不变的情况下,它的体积变化与温度变化成正比,与0℃时的体积成正比,即它的体积随着温度作直线变化,其数学表达式为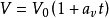 。式中V 为气体在t℃时的体积;
。式中V 为气体在t℃时的体积;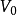 为0℃时的体积;
为0℃时的体积;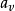 是在压强不变时,气体体积随温度变化的係数,称做体膨胀係数。
是在压强不变时,气体体积随温度变化的係数,称做体膨胀係数。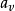 可由实验测定。
可由实验测定。
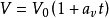
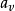
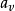
查理定律:
它反映了气体压强随温度变化而变化的规律。一定质量的气体,当其体积保持不变时,它的压强P 变化与温度T 的变化成正比,与0℃时气体的压强成正比,即压强随温度作直线变化,其数学表达式为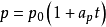 。式中P 为气体在t℃时的压强;P0为气体在0℃时的压强;
。式中P 为气体在t℃时的压强;P0为气体在0℃时的压强;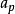 为体积不变时,气体压强随温度变化的係数,称作压强係数。
为体积不变时,气体压强随温度变化的係数,称作压强係数。
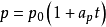
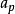
理想气体状态方程
波义耳-马略特定律,盖·吕萨克定律及查理定律给出了一定质量的气体的三个参量P、V、T 中有一个保持不变时,另两个状态参量的变化规律。但是,在实际中,这三个参量往往是同时变化的。对于一定质量的理想气体,在平衡状态下,压强P、体积V 和温度T 之间存有一定的关係,可用两种形式来表示。其一是式中角码1和2分别代表系统所处的两个平衡态。其二是或者写成 。式中M、n和μ分别是气体的质量、摩尔数和摩尔质量,R 为普适气体常数。这种形式亦称为克拉珀龙方程。以上两种形式都是理想气体状态方程。理想气体状态方程表明:一定质量的气体,当其状态发生变化时,它的任意两个平衡态的状态参量之间的关係。对一定质量的气体,P、V、T 三个状态参量,并不全是独立的,任何两个参量确定之后,第三个参量也就唯一地确定了,只需两个独立参量,即可描述理想气体的状态。
。式中M、n和μ分别是气体的质量、摩尔数和摩尔质量,R 为普适气体常数。这种形式亦称为克拉珀龙方程。以上两种形式都是理想气体状态方程。理想气体状态方程表明:一定质量的气体,当其状态发生变化时,它的任意两个平衡态的状态参量之间的关係。对一定质量的气体,P、V、T 三个状态参量,并不全是独立的,任何两个参量确定之后,第三个参量也就唯一地确定了,只需两个独立参量,即可描述理想气体的状态。

 读书笔记摘抄新闻资讯
读书笔记摘抄新闻资讯